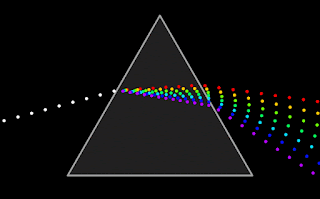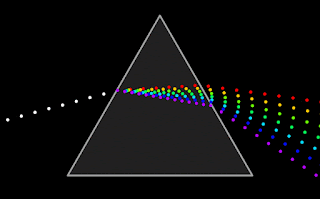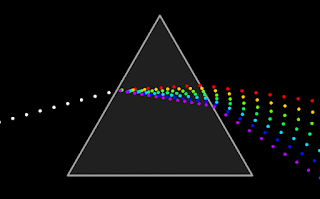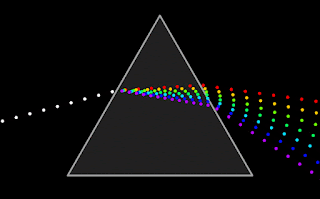
Cuando se hace pasar la luz blanca por un prisma, ésta se descompone en las radiaciones monocromáticas que la forman, en un proceso denominado dispersión:
Al calentar un elemento hasta que llega a la incandescencia, se produce una emisión de luz que, al hacerla pasar por un prisma, se descompone en forma de un espectro discontinuo, que consta de una serie de líneas correspondientes a determinadas frecuencias y longitudes de onda. Cada elemento químico tiene un espectro propio y característico, diferente de los espectros de los demás elementos, por lo que sirve para identificarlo.
En este vídeo puedes ver los colores producidos por diferentes sustancias al calentarlas a la llama:
Al pasar las radiaciones emitidas en la llama a través de un espectroscopio:
se pueden obtener los espectros de los diferentes elementos. Por ejemplo:
La espectroscopia es una técnica habitual de estudio aplicada tanto en Química como en Física.
El origen de los espectros era desconocido hasta que en 1913 el físico Niels Bohr asoció la emisión de radiación por parte de los átomos con el comportamiento de los electrones, en concreto con la distancia a la que éstos se encuentran del núcleo.
Bohr propuso un nuevo modelo atómico (Modelo de energía cuantizada), que se basa en los siguientes postulados:
1. Los electrones giran alrededor del átomo en órbitas estacionarias, sin emitir energía.
2. La energía asociada a cada órbita aumenta desde el núcleo hacia el exterior.
3. Para que un electrón pase de una órbita interna a otra más externa, hay que suministrarle energía. Si el electrón pasa de una órbita externa a otra más interna, la diferencia de energía se emite en forma de radiación electromagnética. Cuando los electrones se encuentra en su órbita, se dice que están en estado fundamental; cuando pasan a una órbita de mayor energía, se encuentran en estado excitado.
4. Sólo son posibles órbitas con determinados valores de energía (energía cuantizada).
5. Cómo máximo, un átomo solo pueden contener 7 órbitas, esto es, 7 niveles de energía.
1. Basándote en los postulados del modelo de Bohr, trata de justificar:
- La emisión de los espectros electromagnéticos
- La dilatación de los metales por el calor
2. ¿Por qué se dice que los espectros son la "huella dactilar" de los elementos químicos?
3. ¿Qué idea nueva introduce Bohr dentro del átomo?
4. Elabora una tabla de doble entrada situando, por una parte, los modelos atómicos (Thomson, Rutherford, Bohr) y por otra, los siguientes aspectos: nombre del modelo ; hechos experimentales en los que se basa; postulados del modelo; nueva idea que introduce en la estructura del átomo.
- Construcción de un espectroscopio casero





No hay comentarios:
Publicar un comentario