Los modelos anteriores no acababan de justificar el comportamiento de átomos polielectrónicos, por lo que era necesario plantearse modificaciones o buscar un nuevo modelo de átomo.
Diversos descubrimientos producidos tanto en el ámbito de la Química como de la Física, llevan a proponer un nuevo modelo atómico, basado en unas nuevas leyes de la mecánica, la Mecánica Cuántica:
Hipótesis de Planck : La luz está formada por partículas o cuantos de energía denominados fotones.
Dualidad onda-partícula de De Brooglie: A nivel cuántico la materia se comporta como onda y como partícula a la vez.
Principio de Indeterminación de Heisenberg: No es posible determinar simultáneamente la posición y la velocidad de un electrón.
Ecuación de onda de Scrödinger: Ecuación del movimiento ondulatorio aplicada al electrón.
Principio de exclusión de Pauli: En un orbital atómico, se pueden situar como máximo dos electrones.
Hipótesis de Planck : La luz está formada por partículas o cuantos de energía denominados fotones.
Dualidad onda-partícula de De Brooglie: A nivel cuántico la materia se comporta como onda y como partícula a la vez.
Principio de Indeterminación de Heisenberg: No es posible determinar simultáneamente la posición y la velocidad de un electrón.
Ecuación de onda de Scrödinger: Ecuación del movimiento ondulatorio aplicada al electrón.
Principio de exclusión de Pauli: En un orbital atómico, se pueden situar como máximo dos electrones.
Según el modelo atómico actual:
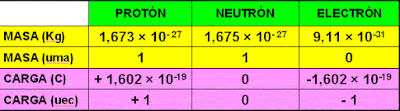
- El átomo consta de dos partes, el núcleo, en el que se encuentran los protones y los neutrones (y por tanto la masa del átomo)
- La corteza, separada del núcleo por espacio vacío. En ella se encuentran los electrones.
- El concepto de órbita, como un recorrido circular plano entorno al núcleo se ha sustituido por el de orbital atómico: zona del espacio en torno al núcleo en la cual la probabilidad de encontrar a un electrón es máxima.
Los orbitales atómicos son zonas de probabilidad, esto es, no podemos localizar con exactitud y precisión la posición del electrón en su movimiento entorno al núcleo.
Adoptan diferentes formas, según el recorrido que realice el electrón, y así hablamos de orbitales tipo s, tipo p, tipo d o tipo f:
Para hacer la CONFIGURACIÓN ELECTRÓNICA, la distribución en la corteza de los electrones de un átomo, tenemos que tener en cuenta el número de electrones que caben, como máximo en cada tipo de orbital:
Y seguir el orden indicado en el diagrama de Moeller:
Ejemplos:
Distribución electrónica de un átomo con 15 electrones (fósforo, P):
1s2
2s2 2p6 3s2 3p3
Distribución electrónica del cromo (Cr) que tiene 24 electrones:
1s2
2s2 2p6 3s2 3p6 4s2 3d4
Distribución electrónica del elemento de Z = 34:
Se trata del Selenio (Se) : 1s2
2s2 2p6 3s2 3p6 4s2 3d104p4
1. Escribe la configuración electrónica de los elementos siguientes:
a) Cloro
b) Elemento de Z = 40
c) Potasio
3. Un elemento químico tiene número atómico Z= 26 y número másico A = 56. Indica cuántas partículas tiene en el núcleo, de qué tipo y cuál es la configuración electrónica de su corteza.
2. Indica qué elemento químico tiene la configuración electrónica fundamental: 1s2
2s2 2p6 3s2 3p6 4s2 3d104p65s1
TRABAJO VOLUNTARIO
Elabora un póster con los diferentes modelos atómicos
TRABAJO VOLUNTARIO
Elabora un póster con los diferentes modelos atómicos